Zelldynamik mithilfe von Licht steuern
Krankheiten haben ihren Ursprung in der Regel in einem bestimmten Organ oder Gewebe im menschlichen Körper. Medikamente werden meist jedoch ganzheitlich verabreicht und nicht nur am Ort der Erkrankung. Dies kann zur Schädigung des gesunden Gewebes und zu unerwünschten Nebenwirkungen führen. Deshalb zielt die Photopharmakologie darauf ab, Moleküle zu entwickeln, die durch fokussierte Belichtung aktiviert und so auf einen kleinen Wirkungsbereich begrenzt werden können. In einem gemeinsamen Projekt an der Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) haben die Forschungsgruppen von Prof. Dr. Henry Dube, Lehrstuhl für Organische Chemie I, und Prof. Dr. Esther Zanin, Professur für Experimentelle Molekulare Zelldynamik, nun lichtsteuerbare Rhodanine entwickelt, durch welche der Tod von Krebszellen mittels Licht ausgelöst wurde. Ihre Erkenntnisse haben die Forschungsgruppen im Journal of the American Chemical Society veröffentlicht.
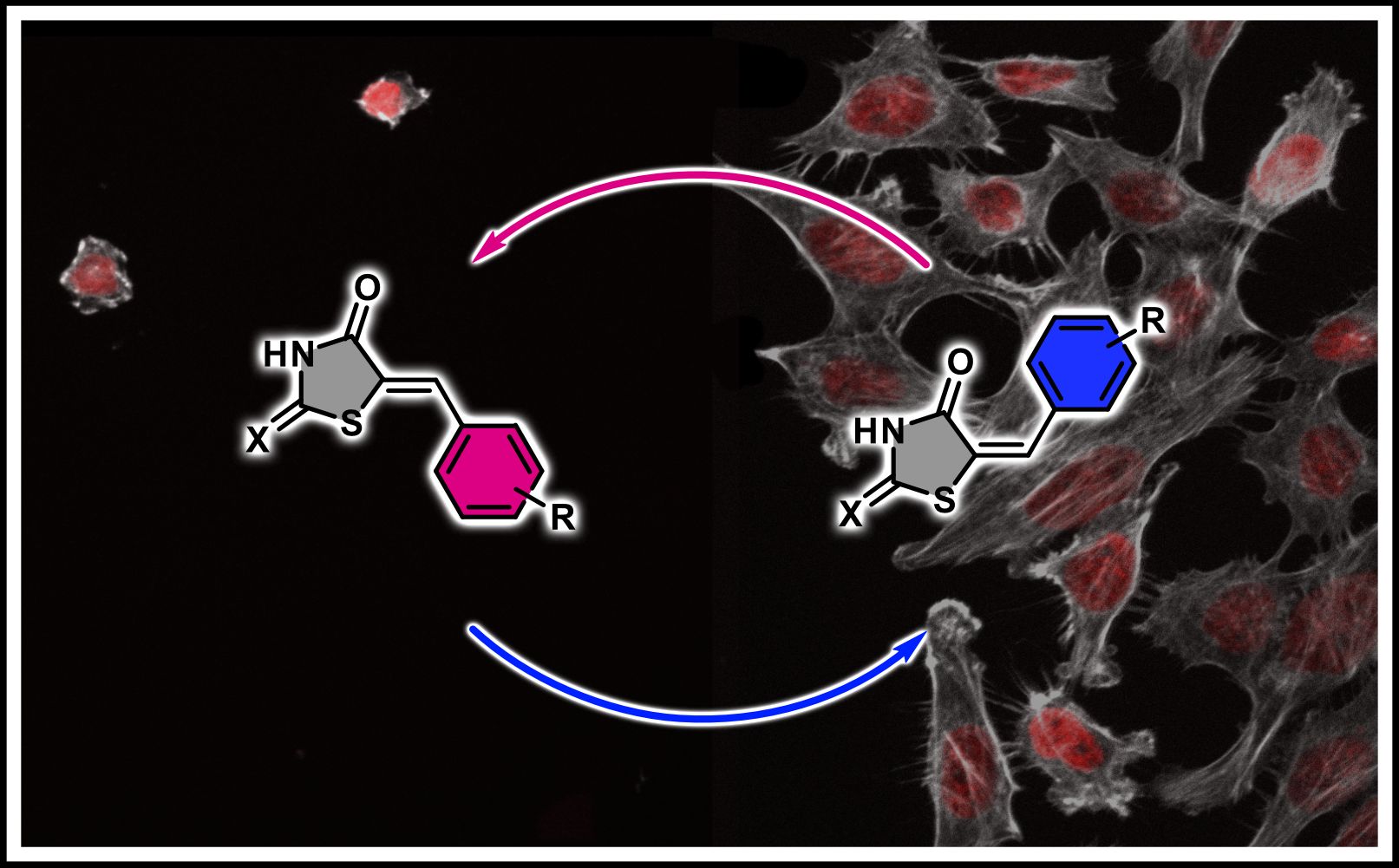
Bei den neu entwickelten Photoschaltern, sogenannten oxo-Rhodaninen, handelt es sich um lichtempfindliche Farbstoff-Moleküle, die auf die Bestrahlung durch UV- beziehungsweise Blaulicht reagieren. Sie wurden innerhalb von Prof. Dubes Arbeitsgruppe hergestellt und charakterisiert. Dabei zeigte sich, dass die neuen Moleküle als Reaktion auf Belichtung strukturelle, chemische und physikalische Veränderungen durchlaufen, die aber reversibel sind. Wie bei einem Schalter, der Licht an- oder ausschaltet, gibt es auch bei diesen Molekülen die Möglichkeit, anhand von Lichteinstrahlung kontrolliert zwischen zwei verschiedenen Zuständen zu wechseln.
Die zwei Zustände, genannt Z-Isomere und E-Isomere, sind maßgeblich abhängig von den im Molekül enthaltenen chemischen Verbindungen. Beide unterscheiden sich nicht in ihrer chemischen Zusammensetzung, aber in ihrer räumlichen Struktur, was beispielsweise zur Folge hat, dass die Z-Isomere der Photoschalter gelb, die E-Isomere orange oder rot gefärbt sind. Ein weiterer Unterschied liegt in der Stabilität der Schaltzustände, die beim Z-Isomer stärker ausgeprägt ist als beim E-Isomer. Zudem kann das E-Isomer aufgrund seiner Struktur nicht mit bestimmten Proteinen interagieren, das Z-Isomer jedoch schon.
In der nun publizierten Arbeit zeigen die Forschenden, dass die oben beschriebenen Eigenschaften einfach verändert und eingestellt werden können, indem ein vorhandenes Schwefelatom im Rhodanin-Photoschalter durch ein Sauerstoffatom ersetzt wird. In den dadurch erhaltenen oxo-Rhodanin-Photoschaltern ist dann beispielsweise die Stabilität der Schaltzustände stark verbessert. Das Vorhandensein der Schwefel- bzw. Sauerstoffatome ist außerdem wichtig, um die Interaktion mit anderen Molekülen und Proteinen zu ermöglichen.
Molekulare Photoschalter in Krebszellen
Da Rhodanine die Arbeitsweise von Proteinen beeinflussen können, ist ein wichtiger Anwendungsbereich die Krebsforschung, wo nun die Interaktion der beiden Isomere mit dem Signalprotein PIM-1 analysiert wurde.
Innerhalb von Prof. Zanins Arbeitsgruppe wurde die Wirkung der entwickelten oxo-Rhodanin-Moleküle auf menschliche Krebszellen untersucht und bewiesen, dass ihre durch Licht gesteuerte Aktivität das Überleben von Krebszellen beeinflussen kann. Dafür wurden Krebszellen angezüchtet und entweder mit dem Z- oder dem E-Isomer behandelt, um zu erforschen, in welchem Zustand die Moleküle biologisch aktiv sind.
Im Versuch konnte bei den Krebszellen mit Z-Isomer der Zelltod beobachtet werden. Der Hintergrund hierfür ist das Schlüssel-Schloss Prinzip, welches besagt, dass das Z-Isomer in die Bindungstasche der PIM-1 Kinase – ein Enzym des Signalproteins – passt und so dessen Aktivität hemmen kann. In der Folge wird der Zelltod ausgelöst. Anders war es bei Krebszellen, die mit dem E-Isomeren behandelt wurden. Sie überlebten, da das E-Isomer als nicht passender Schlüssel keine Proteinbindung eingehen konnte.
In einem weiteren Schritt wurden nun wieder Zellgruppen entweder mit dem inaktiven E-Isomer oder dem aktiven Z-Isomer behandelt und diesmal zusätzlich zehn Sekunden lang mit Licht beleuchtet. Das Bestrahlen von Zellen mit Z-Isomer durch UV-Licht führte zum Umschalten in das nichtaktive E-Isomer und fast alle Zellen konnten überleben. Umgekehrt führte die Bestrahlung von Zellen, die zuerst mit E-Isomer behandelt wurden, zu einer Umwandlung in ein aktives Z-Isomer und damit zum Zelltod fast aller vorhandenen Zellen. So zeigten die Wissenschaftler/-innen, dass sich die biologische Aktivität der Rhodanine durch Licht an- und ausschalten lässt und damit Lichtsignale für das kontrollierte Absterben von Krebszellen benutzt werden können.
Lichtempfindliche Moleküle für ein breites Anwendungsspektrum
Die Ergebnisse der Untersuchungen der beiden Teams zeichnen rhodaninbasierte Farbstoffe als neue Präzisionswerkzeuge für die Steuerung von Zellsignalen und den Zelltod durch Licht aus.
In der Medizin kann diese Arbeit nun weiterentwickelt werden, um nur in erkrankten Organen, zum Beispiel bei Krebserkrankungen und Entzündungskrankheiten, mit Licht den Zelltod auszulösen. Das mögliche Anwendungsspektrum für lichtgesteuerte Rhodanin-Moleküle ist aber weitaus breiter und könnte beispielsweise auch Anwendung bei der Herstellung von Solarzellen oder Lithium-Ionen-Akkumulatoren finden.
Link zur Studie: https://doi.org/10.1021/jacs.3c07710
Weitere Informationen:
Prof. Dr. Henry Dube
Lehrstuhl für Organische Chemie I
henry.dube@fau.de
Prof. Dr. Esther Zanin
Professur für Experimentelle Molekulare Zelldynamik
esther.zanin@fau.de